دراسة تظهر أن لدى فيروس كورونا عشرة أنواع من البروتينات
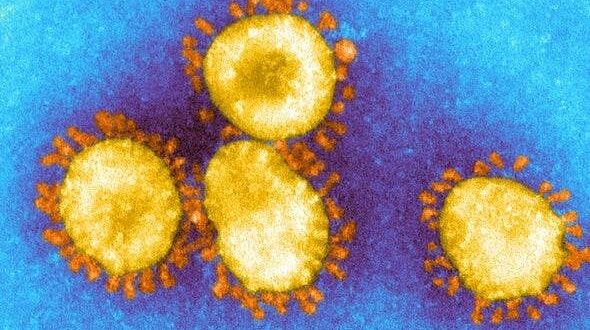
خلصت دراسة طبية حديثة إلى نتيجة قد تُفسد على العلماء كافة الجهود التي يبذلونها حالياً من أجل القضاء على فيروس كورونا المستجد، ووقف انتشاره بين الناس، وتفيد هذه الحقيقة أن لدى الفيروس عشرة أنواع مختلفة من البروتينات التي تقوم بمهمة الالتصاق بالخلايا البشرية، ما يعني أن على العلماء اليوم التغلب على عشرة طرق لهجوم الفيروس وليس طريقة واحدة أو اثنتين.
وحسب الدراسة التي أجريت بالتعاون بين جامعة صينية ومركز بحثي في بريطانيا، ونشرت نتائجها في موقع “لايف ساينس”، فقد وجد العلماء أن فيروس كورونا المستجد يملك طريقة “معقدة للغاية” لربط نفسه بالخلايا البشرية.
واكتشف العلماء أن الفيروس يعتمد على ما يُسمى “بروتينات السنبلة” من أجل الالتصاق بالخلايا البشرية وغزوها، وللقيام بذلك تتحول “السنبلة” إلى 10 أشكال مختلفة على الأقل للالتصاق بالخلايا البشرية.
وأجرى الدراسة علماء من جامعة سون يات سين الصينية ومعهد “فرانسيس كريك” البريطاني، وهو “مركز المملكة المتحدة للأبحاث الطبية والابتكار سابقاً” في لندن.
ويقول العلماء إنه “في حين أن هذا قد يفسر سبب صعوبة العثور على علاجات فعالة للمرض، فإنه يفتح أيضاً طرقاً جديدة محتملة للتحقيق في علاج أو لقاح كوفيد-19”.
وفي بداية الوباء، حدد العلماء بسرعة بنية بروتين السنبلة “spike” ما مهد الطريق لاستهدافه باللقاحات والأدوية الأخرى. ولكن ما يزال هناك الكثير مما لا يعرفه العلماء عن التفاعل بين البروتين والسطح الخارجي للخلايا البشرية.
وقال المؤلف الرئيسي المشارك دونالد بينتون، زميل أبحاث ما بعد الدكتوراه في معهد فرانسيس كريك للبيولوجيا الهيكلية لعمليات المرض في بريطانيا: “إن بروتين السنبلة هو محور الكثير من الأبحاث في الوقت الحالي. وفهم كيفية عمله مهم جدا لأنه هدف معظم محاولات التطعيم والكثير من أعمال التشخيص أيضاً”.
ولفهم عملية العدوى، مزج بنتون وفريقه بروتينات “ACE2” البشرية مع بروتينات “spike” في المختبر، ثم استخدموا الإيثان السائل شديد البرودة لتجميد البروتينات بسرعة بحيث تصبح “معلقة في شكل خاص من الجليد” وفقاً لبنتون.
ثم وضعوا هذه العينات تحت المجهر الإلكتروني المبرد وحصلوا على عشرات الآلاف من الصور عالية الدقة للبروتينات المجمدة وهي مراحل مختلفة من الارتباط بالخلية البشرية.
ووجدوا أن بروتين السنبلة الذي ينتج عن فيروس كورونا يخضع لتغيرات في الشكل عندما يرتبط بالخلية البشرية، وبعد أن يرتبط البروتين يصبح هيكله أكثر انفتاحا للسماح بمزيد من الارتباط، وهو ما يزيد من انتشار المرض ويُسهل من انتقال الفيروس عبر هذه البروتينات.
وقال بنتون: “إنها عملية ربط مستقبلات معقدة للغاية مقارنة بمعظم بروتينات السنبلة في الفيروس. الإنفلونزا وفيروس نقص المناعة لديها عملية تنشيط أكثر بساطة”. وأضاف أن فيروس كورونا مغطى ببروتينات سبايك، ومن المحتمل أن جزءا صغيرا منها فقط يمر بهذه التغييرات التوافقية، ويرتبط بالخلايا البشرية ويصيبها.
وأشار المؤلف الرئيسي المشارك أنتوني روبل، وهو أيضا زميل أبحاث ما بعد الدكتوراه في معهد فرانسيس كريك للبيولوجيا الهيكلية لعمليات المرض: “نعلم أن بروتين سبايك يمكن أن يتبنى كل هذه الحالات التي كنا نتحدث عنها. لكن إذا كانت كل بروتينات سبايك تعتمد عليها جميعاً لا يمكننا تحديد ذلك، لأنه يمكننا رؤية نوع واحد من اللقطات فقط”.
ويقول الباحثون إن بروتين سبايك سريع التغيير في المختبر، ويمكن أن يتحول إلى كل هذه التشكيلات المختلفة في أقل من 60 ثانية. لكن بنتون أوضح أن: “هذا سيكون مختلفاً تماماً في حالة العدوى الحقيقية، كل شيء سيكون أبطأ لأن المستقبل سوف يكون عالقاً على سطح الخلية، لذا عليك إتاحة الوقت للفيروس للانتشار إلى هذا المستقبل”.
وقال: “قد يكون هذا وسيلة للفيروس لحماية نفسه من تعرف الأجسام المضادة عليه”. وأضاف أنه عندما يكون بروتين سبايك في حالته المغلقة، فإنه يخفي الموقع الذي يرتبط بالمستقبل وهو الخلية البشرية، ربما لتجنب دخول الأجسام المضادة والارتباط بهذا الموقع بدلا من ذلك.
وأشار الفريق إلى أن الشكل المتغير لبروتين السنبلة كشف عن المزيد من الأسطح التي يمكن أن تستهدفها اللقاحات والعقاقير المحتملة.
ويقول روبل: “يمكننا بعد ذلك البدء في التفكير في العلاجات التي يمكن أن تناسب مكاناً ما إما في سطح المستقبل أو في مكان ما في بروتين السنبلة نفسه”.
ويأمل العلماء في معرفة سبب مرور الفيروس التاجي بالعديد من التغييرات التوافقية، وكيف يقارن ذلك بالفيروسات التاجية الأخرى، وما إذا كانت هذه التغييرات قد تساعد في تفسير سبب انتشار هذا الفيروس الجديد بسهولة.
المصدر: لايف ساينس
 وكالة أوقات الشام الإخبارية
وكالة أوقات الشام الإخبارية